Les carottes de glace de l’Antarctique et les mesures directes de concentration du CO2 dans l’atmosphère, à Hawaii, en Antarctique et ailleurs, montrent une relative stabilité autour de 280 ppmv avant le XIXe siècle, puis une augmentation de plus en plus importante à partir du moment où l’humanité à commencer à utiliser les combustibles fossiles : charbon d’abord, puis pétrole et gaz. La concentration a maintenant atteint les 420 ppmv. La coïncidence entre les émissions humaines de CO2 et la hausse de la teneur en CO2 dans l’atmosphère amène à penser que les premières sont responsables de la seconde. C’est une conclusion évidente que tous les scientifiques admettent, sauf quelques individus plus ou moins liés aux lobbys des énergies fossiles ou mus par des convictions idéologiques.
Trois raisons de penser que la hausse de la teneur en CO2 atmosphérique est d’origine humaine
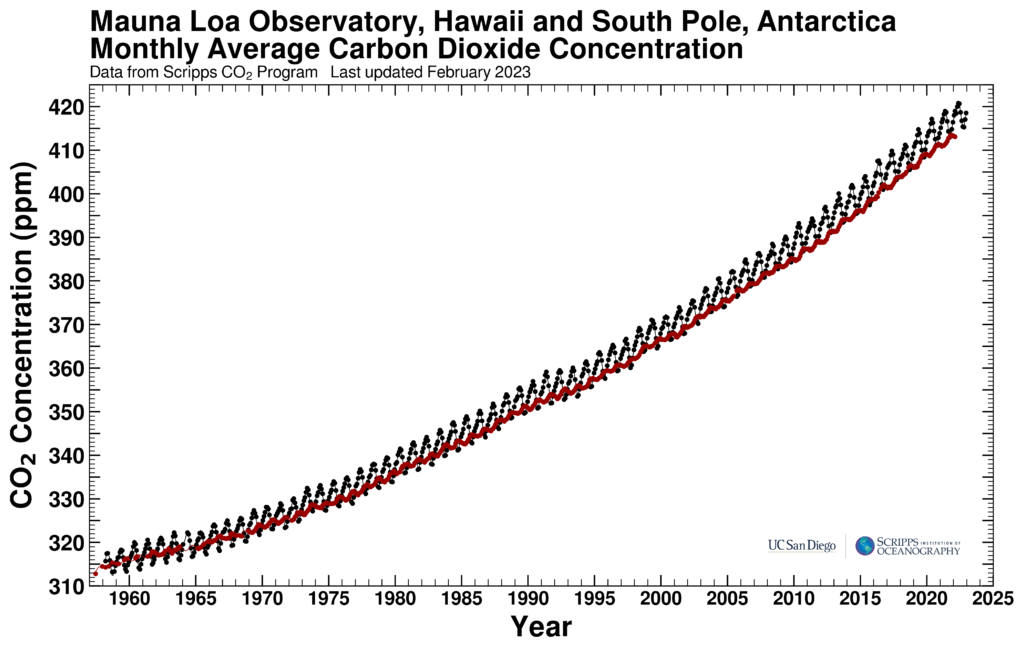
La première raison de penser que l’augmentation de la teneur en CO2 est (en grande partie) causée par la combustion de charbon, de produits pétroliers et de gaz, est qu’il s’accumule plus dans l’hémisphère Nord que dans l’hémisphère Sud, or c’est essentiellement au nord qu’on utilise. Sa concentration est mesurée depuis 1958 à Hawaii et au pôle Sud. Les deux courbes se superposent assez bien. À première vue, leurs différences viennent du fait que les variations saisonnières observées dans l’hémisphère Nord, dues à ses forêts, ne sont pas visibles dans l’hémisphère Sud, où les forêts sont beaucoup moins abondantes. Mais en y regardant de plus près, on voit que la concentration du CO2 augmente un peu moins au sud qu’au nord. Depuis 1958, la différence est passée de presque 0 à près de 4 ppmv.
La deuxième raison est plus subtile : elle fait appel à la composition isotopique du carbone. Les molécules de CO2 sont constituées d’un atome de carbone et de deux atomes d’oxygène, mais le carbone possède plusieurs isotopes. Le plus abondant est le carbone 12, dont les noyaux ont 6 protons et 6 neutrons. Son abondance est de 98,93 %. Le reste, soit 1,07 %, est composé de carbone 13, avec 6 protons et 7 neutrons. Ces noyaux sont plus lourds de 8 % que ceux de carbone 12, suffisamment pour influer sur la cinétique des réactions chimiques. Mais on comme va le voir, le rapport 13C/12C varie très légèrement selon les milieux considérés.
Il existe aussi une infime proportion de carbone 14, connu pour son utilisation en archéologie, dont la demi-vie est 5 730 ans. Il est créé dans la haute atmosphère par réaction de l’azote avec des rayons cosmiques. Les noyaux d’azote 14 absorbent un neutron en expulsant un proton, ce qui les transforme en noyaux de carbone 14, avec 6 protons et 8 neutrons. Dans l’atmosphère, il y a un atome de carbone 14 (oxydé en 14CO2) pour 830 milliards d’atomes de carbone 12. Par la photosynthèse, la végétation assimile ces atomes, mais leurs noyaux redeviennent des noyaux d’azote 14 par radioactivité bêta, si bien qu’au bout d’environ 50 000, il en reste très peu : une demi-vie de 5 730 ans signifie que le nombre de noyaux est divisé par 2 tous les 5 730 ans.
Lors de la photosynthèse, les plantes et le phytoplancton assimilent préférentiellement du carbone léger (on parle de fractionnement isotopique). Ils sont donc appauvris en carbone 13 par rapport à leur environnement. Les géochimistes ont défini un nombre noté δ13C (delta 13 C), à partir du rapport 13C/12C. Plus ce rapport est petit, plus le δ13C est bas. Il est voisin de 1,5 ‰ (un virgule cinq pour mille) pour les ions bicarbonate de l’eau de mer et il vaut – 6,4 ‰ pour le CO2 atmosphérique. Il varie entre – 12 et – 29 ‰ pour les plantes terrestres et il a des valeurs comparables pour le pétrole et le charbon (formés à partir de plancton, d’algues et de plantes). Dans le gaz naturel, principalement constitué de méthane, il peut descendre beaucoup plus bas. C’est donc lui qui est le plus appauvri en carbone 13.
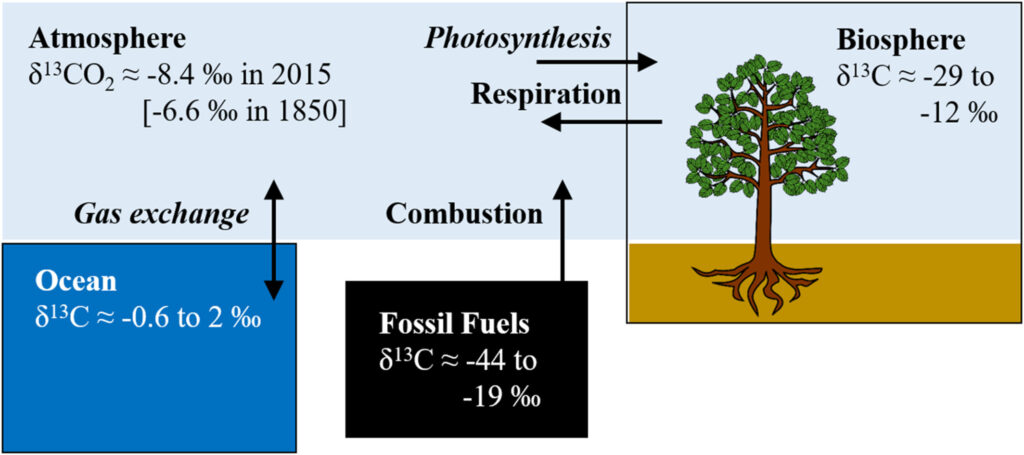
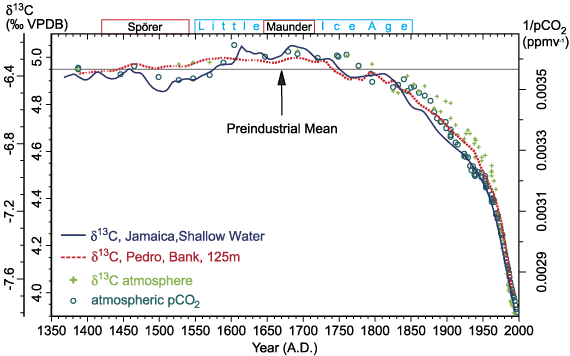
Par conséquent, quand on brûle des combustibles fossiles, on émet dans l’atmosphère du CO2 allégé, avec un δ13C de l’ordre de – 25 ‰ (Friedli et al., 1986). Avec tout ce qui a été émis depuis le début de l’ère industrielle, le δ13C du CO2 atmosphérique devrait décroître, et c’est bien ce que l’on observe. En fait, la valeur de – 6,4 ‰ est celle qui est mesurée dans l’air des carottes de glace pré-industrielles. En 2015, cette valeur était plutôt de – 8,4 ‰. On effectue des mesures directes dans l’atmosphère depuis 1978, notamment grâce aux observatoires du Mauna Loa et du pôle Sud (Keeling et al., 2017).
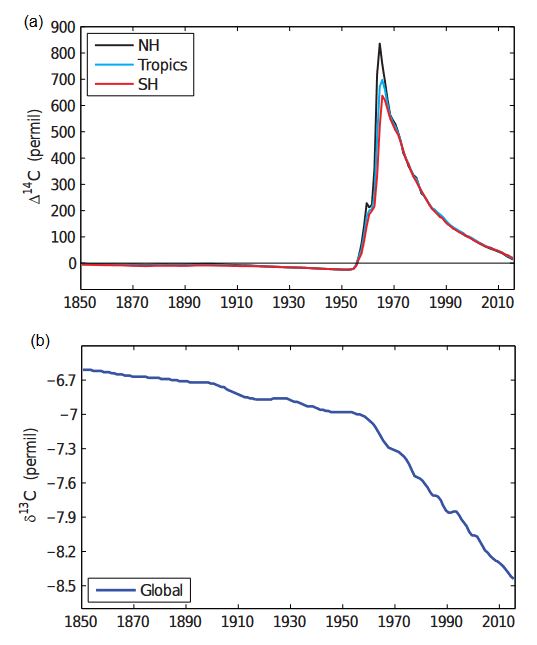
Ce qui vaut pour le carbone 13 vaut également pour le carbone 14. Les plantes absorbent moins de carbone 14 que de carbone 12, mais en plus, cet isotope disparaît au bout de quelques dizaines de milliers d’années. Les veines de charbon, qui proviennent de forêts ensevelies surtout durant le Carbonifère et le Permien, il y a entre 359 et 252 millions d’années, en sont totalement dépourvues. Le pétrole et le gaz naturel sont également très anciens, si bien qu’ils ne contiennent pas un seul atome de carbone 14. Il en résulte que l’utilisation de ces combustibles devrait faire diminuer le rapport 14C/12C dans l’atmosphère. Cet effet a été observé pour la première fois en 1955 par le physicien autrichien Hans Suess (1909-1993). Plus les anneaux de croissance des arbres sont éloignés de l’écorce, plus ils sont anciens. Ils devraient donc être appauvris en carbone 14, d’où une moindre radioactivité. Or ils se sont révélés être plus appauvris que prévu, à cause de l’émission dans l’atmosphère d’un CO2 totalement dépourvu de carbone 14 et consommé par les arbres. On appelle cela l’effet Suess. Bien entendu, les anneaux de croissance des arbres témoignent également de la baisse du δ13C.
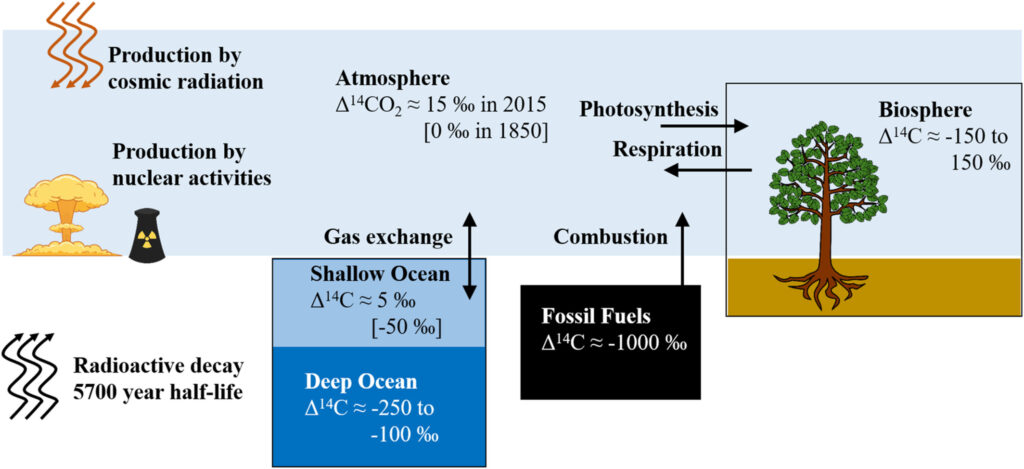
On définit un Δ14C, traduisant l’activité radioactive (et non la concentration) du carbone 14, qui vaut – 1000 ‰ en l’absence totale de carbone 14 et 0 ‰ dans une atmosphère où la production de carbone 14 compense exactement son déclin radioactif, comme c’était le cas avant 1850. L’utilisation des combustibles fossiles a fait baisser ce Δ14C jusqu’à – 20 ‰, puis les essais nucléaires aériens entre 1952 et 1965 l’ont fait grimper jusqu’au-dessus de + 600 ‰. Suite à leur interdiction, il retombe.
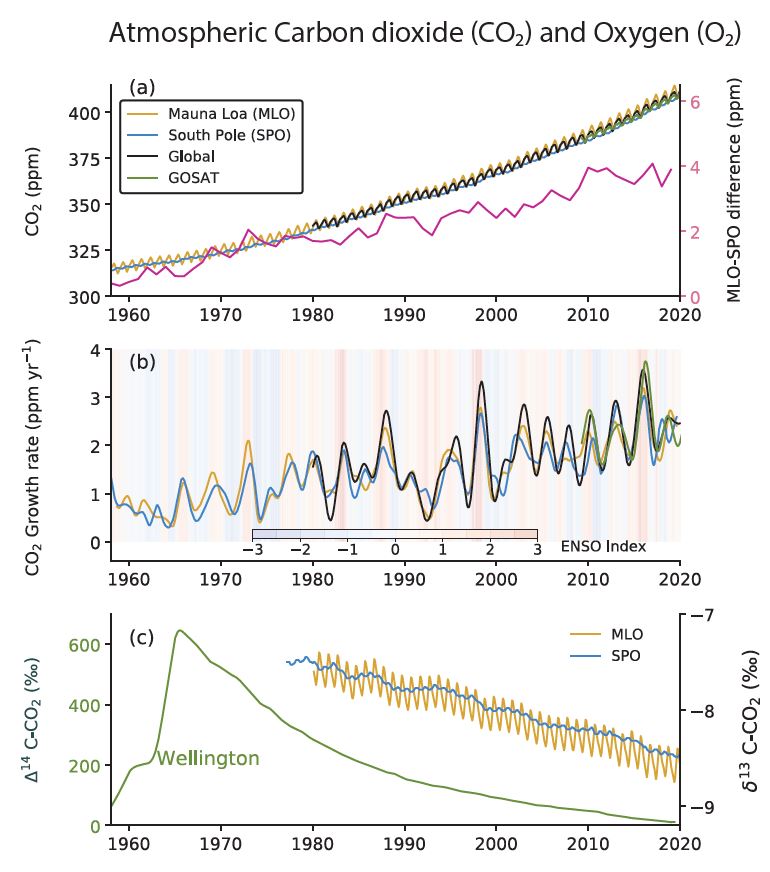
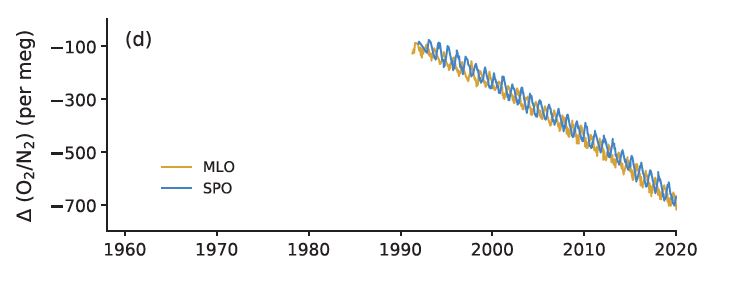
Enfin, l’utilisation de combustibles fossiles devrait diminuer la teneur en oxygène dans l’atmosphère. Il y en a beaucoup (heureusement pour nous !) : la concentration du dioxygène dans l’air sec est de 20,95 % en volume. La combustion du charbon ou des produits pétroliers a donc un effet minime, mais il est mesurable. Pour chaque atome de carbone brûlé, de 1,17 à 1,98 molécule de dioxygène est consommée, et c’est effectivement ce que l’on observe. L’évolution du rapport dioxygène/diazote 02/N2 a été mesurée au Japon, au sol et à bord d’un avion à différentes altitudes, dans les années 2000-2010. Les résultats ont été présentés par Shigeyuki Ishidoya et al. en 2012. Outre des variations saisonnières, une baisse continuelle de ce rapport est observée, corrélativement à la hausse de la concentration du CO2 atmosphérique.
Les forêts et les océans comme puits de carbone
Tout cela est suffisant pour conclure que l’humanité a modifié de manière substantielle le stock de CO2 dans l’atmosphère par l’utilisation massive des combustibles fossiles. On peut cependant ajouter que les scientifiques savent calculer les émissions anthropiques de CO2 et d’autres gaz à effet de serre, or avec tout ce qui a été émis depuis 1750, il devrait y avoir bien plus de CO2 que maintenant. La seule explication possible est qu’une partie a été absorbée par la végétation et les océans.
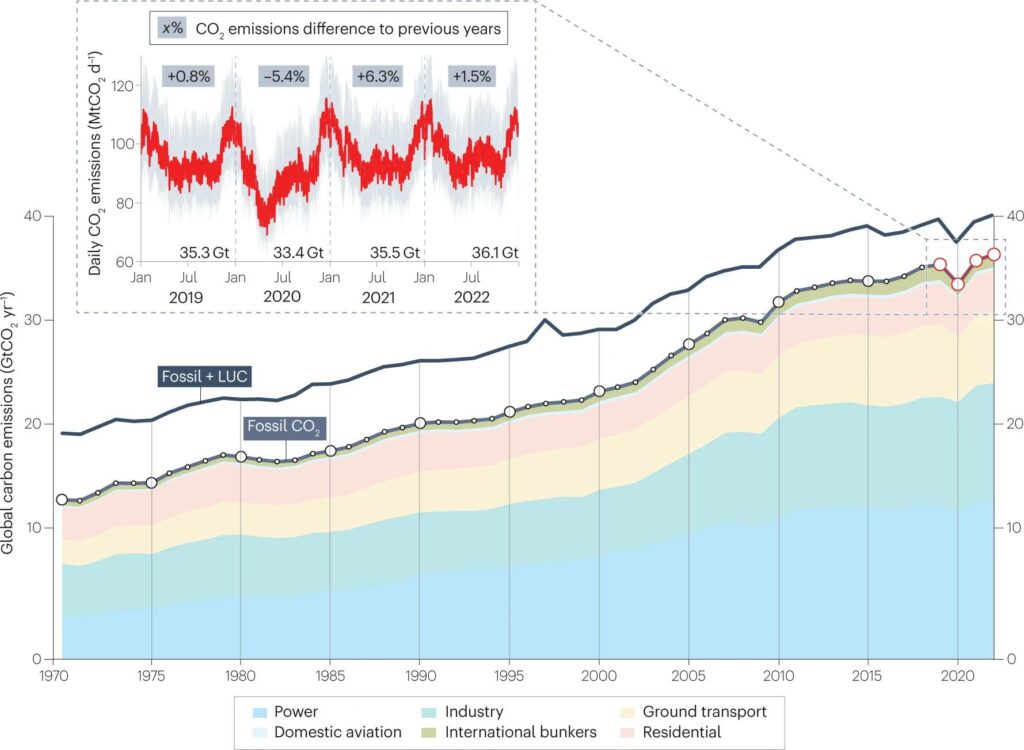
Les carottes de glace ont permis de savoir qu’en 1750, il y avait environ 278 ppmv de CO2 dans l’atmosphère. Pour savoir quelle masse de carbone cela représente, on multiplie 278 × 10–6 par le rapport 12,01/28,97 entre la masse molaire atomique du carbone (12,01 g/mol) et la masse molaire de l’air sec (28,97 g/mol), puis par la masse totale de l’atmosphère, estimée à 5,148 × 1018 kg. On obtient 5,93 × 1014 kg, soit 593 Gt (gigatonnes) de carbone. Maintenant, la concentration du CO2 a dépassé les 410 ppmv. Le même calcul permet d’estimer la masse actuelle du carbone atmosphérique (en négligeant le méthane) à 875 Gt. Il apparaît donc que 282 Gt de carbone ont été ajoutées, mais d’après l’AR6 (le sixième rapport d’évaluation du GIEC), l’humanité a émis 685 ± 75 Gt de carbone durant la période 1750-2019. Les combustibles fossiles, utilisés à partir de 1850, représentent 445 ± 20 Gt. Le reste provient du changement d’utilisation des sols : déforestation, dégradation, repousse après abandon agricole et drainage des tourbes. Entre 1750 et 1850, c’était la seule cause d’augmentation du carbone atmosphérique.
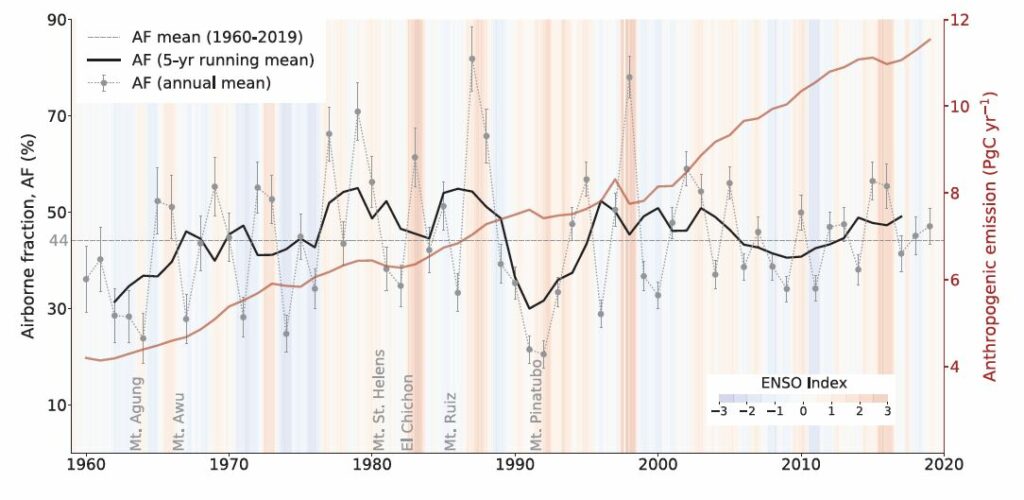
La différence, d’environ 685 – 282 Gt = 403 Gt, correspond à ce que les océans et la végétation ont absorbé. La part des émissions anthropiques restées dans l’atmosphère vaut 282/685, soit environ 41 %. C’est ce que Charles Keeling a appelé en 1973 l’airborne fraction. Pour chaque année, il est possible de déterminer les émissions de carbone et la part qui reste dans l’atmosphère. Ainsi, le taux moyen d’émission était de 10,9 ± 0,8 GtC/an (gigatonnes de carbone par an) durant les années 2010-2019, mais le taux d’accroissement du carbone dans l’atmosphère n’a été que de 5,1 ± 0,02 GtC/an. Cela donne une airborne fraction d’environ 46 %. Les océans et la végétation ont absorbé respectivement 23 % et 31 % de ce carbone. Ce sont des puits de carbone.
Il y a donc eu un accroissement de la biomasse végétale, les plantes profitant de la hausse de la concentration en CO2. Ce gaz a un effet fertilisateur. Sans surprise, c’est l’hémisphère Nord qui contribue le plus à l’assimilation du carbone, notamment les forêts tempérées et boréales. L’efficacité de ce puits paraît s’être accru dans les années 1980. L’étude de Ralph Keeling de 2017 citée plus haut a montré que les plantes utilisent l’eau avec plus d’efficacité, durant les dernières décennies, proportionnellement à la montée du CO2 atmosphérique.
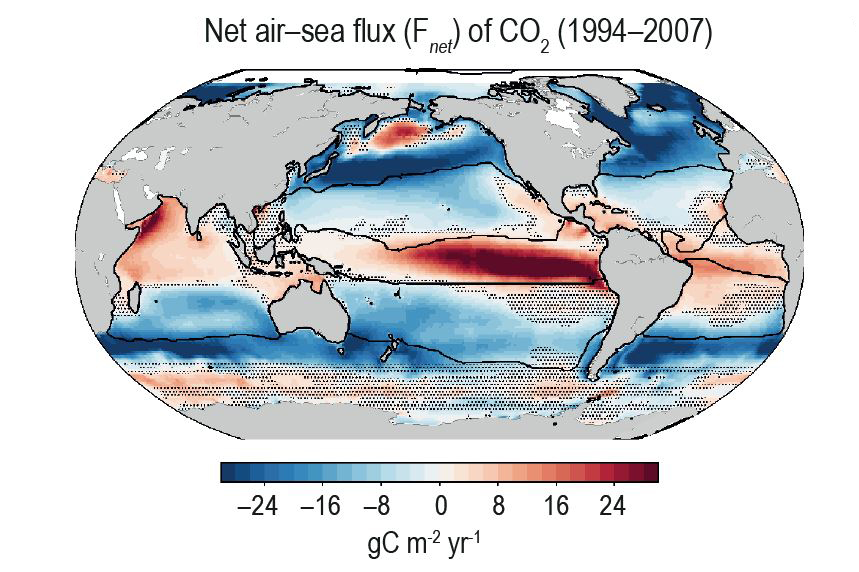
L’absorption du CO2 dans les océans est plus facile à comprendre que son absorption par les forêts. La solubilité des gaz dans l’eau est décrite par la loi de Henry. Cependant, une fois dissous dans les océans, le CO2 réagit avec l’eau H2O et les ions carbonate CO32–présents en grande quantité dans l’eau de mer en donnant des ions bicarbonate 2HCO3 –. Il en résulte que l’absorption de CO2 acidifie les océans, c’est-à-dire faire baisser leur pH. Voisin de 8,25 en 1750, le pH de l’eau de mer est descendu à 8,14 en 2004 d’après Mark Jacobson. La solubilité des gaz augmente quand la température de l’eau baisse, si bien que l’absorption a lieu principalement aux hautes latitudes et que les régions équatoriales peuvent être émettrices de CO2.
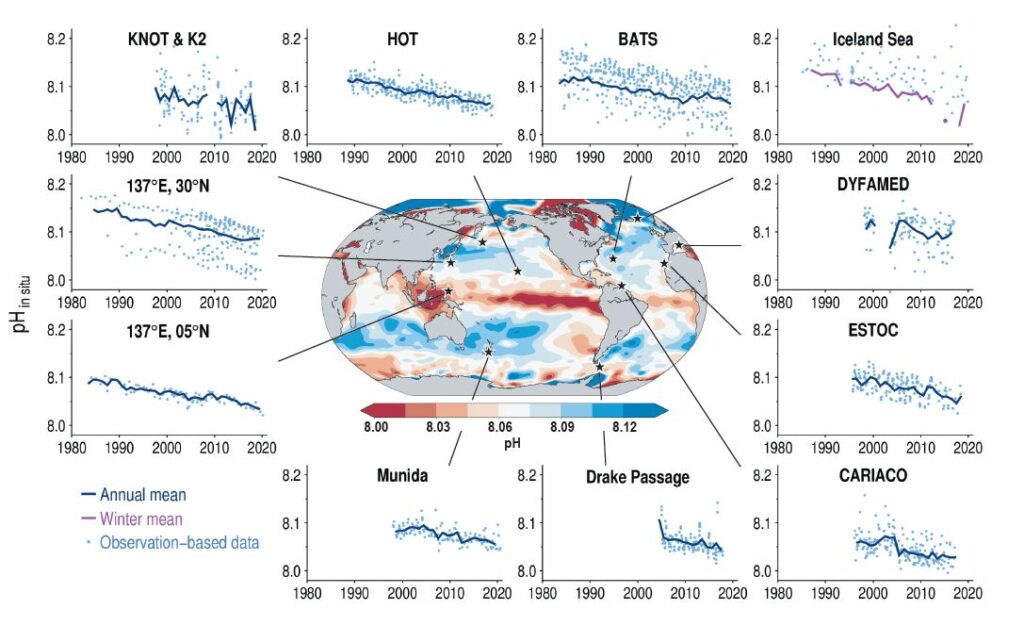
Les réactions chimiques aboutissent à un véritable goulot d’étranglement représenté par le facteur de Revelle, portant le nom de l’océanographe Roger Revelle (1909-1991). Il est voisin de 10, ce qui signifie qu’une variation de la concentration du CO2 atmosphérique se traduit par une variation environ 10 fois plus faible du CO2 dissous dans la couche de surface bien brassée par les courants. À cela, s’ajoute le fait que la diffusion du carbone dans les profondeurs n’est pas immédiate. Il faut un an pour équilibrer l’atmosphère et la couche superficielle de l’océan, dite « couche de mélange », profonde de 50 à 100 mètres. Quant aux échanges avec les couches intermédiaires et profondes de l’océan, ils sont très lents.
Notions de temps de séjour et de temps d’ajustement
Pour étudier le cycle du carbone, les géochimistes divisent la Terre en plusieurs réservoirs appelés des boîtes, qui sont considérées comme homogènes. Les éléments ou composés chimiques se déplacent entre les boîtes, ce qui se mesure par exemple en gigatonnes par an (Gt/an). Ces échanges sont généralement qualifiés de flux. Modéliser le cycle du carbone, c’est représenter le système terrestre par quelques boîtes communiquant entre elles. Cette représentation simplifiée permet de faire des calculs. Une boîte est dans un état stationnaire si la somme des flux entrants est égale à celle des flux sortants. Le temps de séjour d’un élément est le contenu de la boîte, exprimé par exemple en Gt, divisé par la somme des flux entrants ou sortants, en Gt/an dans le cas présent. La division donne une quantité exprimée en années.
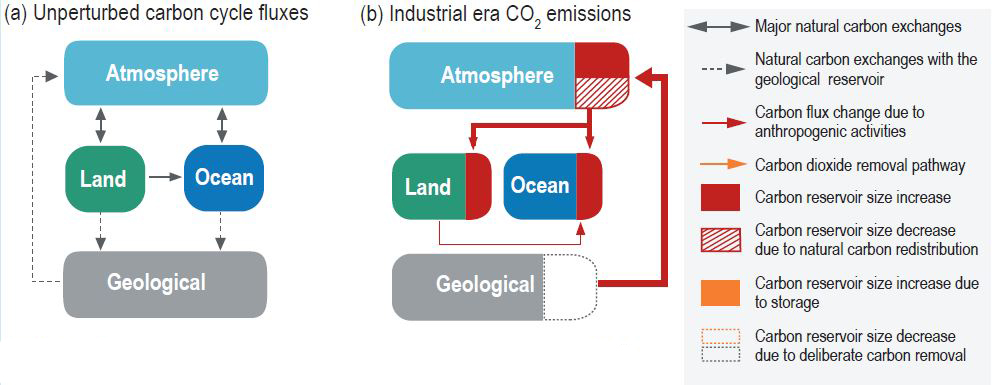
Le cas du carbone montre la difficulté de la modélisation. Les réservoirs sont nombreux et les temps de séjour y sont très variés. Leurs tailles varient d’un facteur 100 000. Le carbone séjourne 4 jours dans le phytoplancton marin et 233 millions d’années dans les calcaires. On comprend qu’il n’est pas possible d’analyser le cycle du carbone avec un seul modèle. On définit un cycle géologique où les échanges se font lentement. Les boîtes sont l’atmosphère, la biosphère et les sols, les océans, les calcaires et la croûte. Le carbone se déplace entre ces différents réservoirs : il est présent dans l’atmosphère sous forme de CO2 (carbone oxydé), dans la biosphère et les sols sous forme de carbone réduit (lié à de l’hydrogène) et dans les calcaires sous forme de CaCO3 (carbone oxydé). On a déterminé que le temps de séjour du carbone dans l’atmosphère est d’un millier d’années.
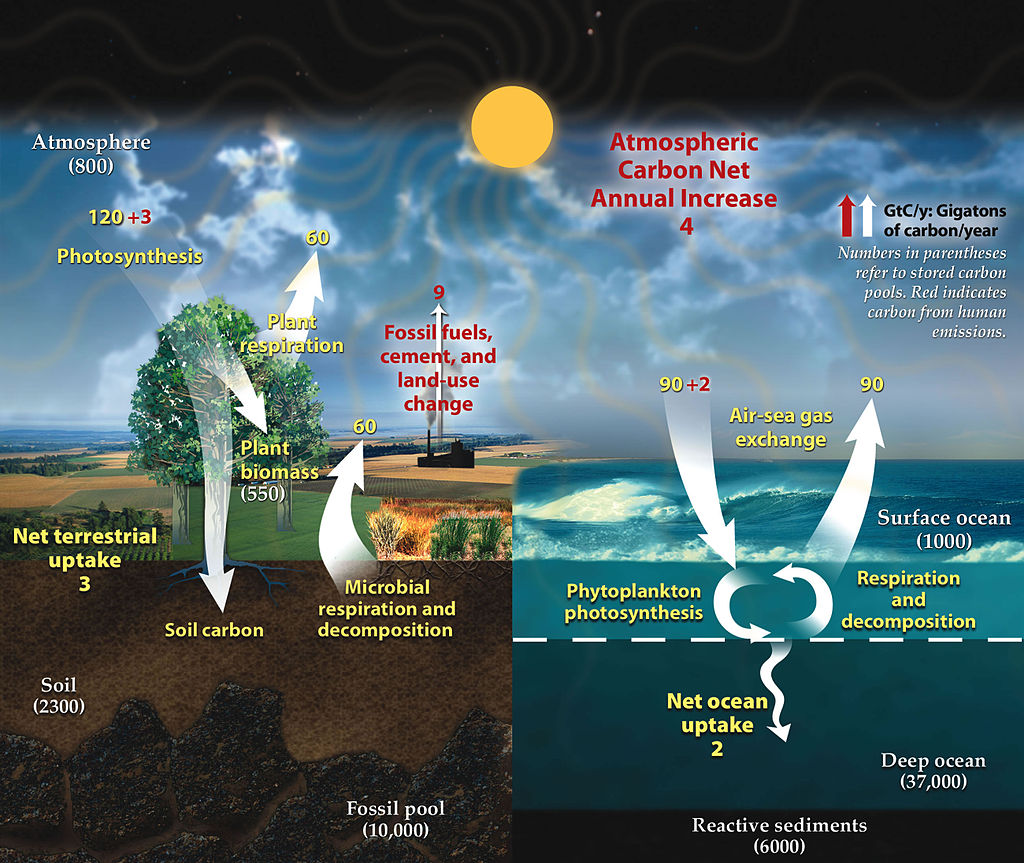
L’action de l’humanité est une véritable perturbation du cycle du carbone. Elle rejette dans l’atmosphère du carbone organique qui avait été piégé dans les sédiments continentaux et marins depuis des dizaines de millions d’années. Pour en tenir compte, les géochimistes ont défini un cycle contemporain où les échanges sont rapides. Dans la modélisation ci-dessus, les réservoirs ont indiqués en blanc et leur contenu est entre parenthèses. Il y a un stock énorme de carbone dans l’océan profond (37 000 Gt), qui est distingué de l’océan de surface (1000 Gt). L’atmosphère contient 800 Gt de carbone et reçoit 9 Gt/an de carbone lié aux activités humaines. On oubliant cet ajout et les 5 Gt/an absorbés par la végétation et les océans, l’atmosphère est dans un état stationnaire. Le flux entrant de (60 + 60 + 90) Gt/an, dû à la respiration des plantes, à la respiration microbienne et à la décomposition, ainsi qu’aux émissions de CO2 par les océans, est égal au flux sortant de (120 + 90) = 210 Gt/an, dû à la photosynthèse et à l’absorption de CO2 par les océans. Le temps de séjour est par conséquent de 800/210 = 3,8 ans.
On est tenté d’interpréter ce résultat par le fait qu’une molécule de CO2 ne reste en moyenne que 3,8 ans dans l’atmosphère avant de passer dans la végétation ou les océans. En réalité, c’est un peu plus compliqué car les entrées et les sorties sont multiples. De plus, le temps de séjour n’est rigoureusement défini que pour des états stationnaires, or l’atmosphère est dans un régime transitoire puisque sa masse de carbone augmente. On peut néanmoins considérer qu’une hausse de 4 Gt/an pour un stock de 800 Gt, ce n’est pas beaucoup.
La masse de CO2 atmosphérique retrouverait-elle son niveau initial de 593 Gt (arrondi ici en 600 Gt pour que ce soit plus facile à lire) en 3,8 ans si les émissions humaines de CO2 étaient annulées ? Non, parce que ce n’est pas la signification du temps de séjour. La végétation et les océans retirent 5 Gt de carbone par an. Pour enlever 800 – 600 Gt = 200 Gt de carbone, il faudrait 200/5 = 40 ans. Mais la décroissance du stock de carbone atmosphérique ne se ferait certainement pas de manière linéaire. Il est plus probable qu’elle soit exponentielle. Sa masse M(t), dépendante du temps, doit valoir 800 Gt pour t = 0. Son taux de variation dM/dt(t) vaudrait initialement – 5 Gt/an mais décroitrait à mesure que M(t) s’approche de 600 Gt :
M(t) = 200 e–t/40 + 600.
On a bien M(0) = 800 Gt et dM/dt(0) = – 5 Gt/an. M(t) tendrait vers 600 Gt quand t augmente sans pouvoir atteindre cette valeur. Elle atteindrait 650 Gt au bout de 55 ans et 610 Gt au bout de 120 ans.
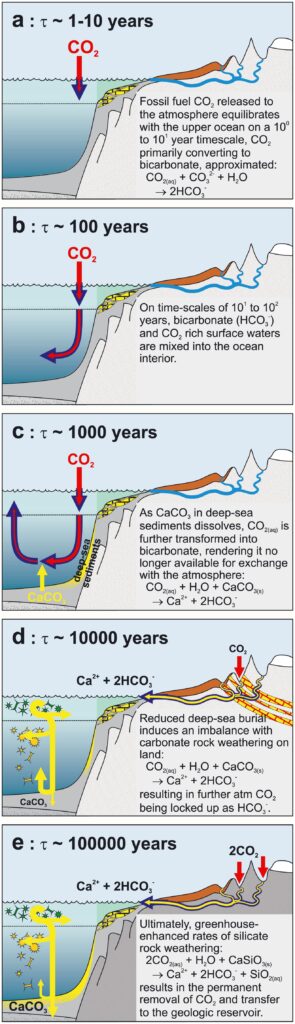
Ce qui a été défini s’appelle un temps d’ajustement (ou d’équilibrage). Quand on ajoute une certaine quantité de CO2 dans l’atmosphère, sa concentration augmente, mais elle retombe ensuite, en fonction de la réponse des différents réservoirs : océan de surface, intermédiaire et profond, sédiments marins et biosphère terrestre. Le temps d’ajustement est celui que met le système à retrouver un équilibre. Il serait voisin de 100 ans, ce qui n’est pas très éloigné de l’estimation grossière donnée ici.
Un article de Natalie Lord et al., 2015 résume les processus en jeu : la dissolution du CO2 dans l’océan de surface et la formation d’ions bicarbonate prend d’une à une dizaine d’années, la pénétration de ces eaux riches en carbone dans l’océan profond une centaine d’années. Comme elles sont appauvries en ions carbonate CO32–, ces eaux accroissent la dissolution du calcaire CaCO3 sédimenté sur les fonds marins, ce qui libère des ions carbonate. Quand elles sont amenées vers la surface, au bout d’un millier d’années, elles se comportent comme un nouveau puits de CO2. Des processus géologiques consommateurs de CO2 se produisent ensuite : la dissolution des calcaires continentaux demande une dizaine de milliers d’années et l’altération des silicates continentaux une centaine de milliers d’années.
Quant à ce qui passe sur les continents, des eaux de surface enrichies en CO2 transfèrent ce carbone dans les océans durant des décennies ou des siècles, pendant que les stocks de carbone fixés dans les sols grâce à la végétation tendent à se rapprocher d’un nouvel quasi-équilibre avec la productivité terrestre et les températures de surface.
******************************************************************************************
F. Böhm et al., Evidence for preindustrial variations in the marine surface water carbonate system from coralline sponges, Geochemistry, Geophysics, Geosystems, 21 March 2002.
Mark Z. Jacobson, Studying ocean acidification with conservative, stable numerical schemes for nonequilibrium air-ocean exchange and ocean equilibrium chemistry, Journal of Geophysical Research Atmospheres, 02 April 2015.
Shigeyuki Ishidoya et al., Time and space variations of the O2/N2 ratio in the troposphere over Japan and estimation of the global CO2 budget for the period 2000–2010, Tellus B: Chemical and Physical Meteorology, 64, 2012.
N.S. Lord et al., An impulse response function for the “long tail” of excess atmospheric CO2 in an Earth system model, Global Biogeochemical Cycles, 18 November 2015.
H. Friedli et al., Ice core record of the 13C/12C ratio of atmospheric CO2 in the past two centuries, Nature 324, pages 237–238, 1986.
Ralph F. Keeling et al., Atmospheric evidence for a global secular increase in carbon isotopic discrimination of land photosynthesis, PNAS, 11 September, 2017.
Jocelyn C. Turnbull et al., Sixty years of radiocarbon dioxide measurements at Wellington, New Zealand: 1954–2014, Atmospheric Chemistry and Physics, Volume 17, issue 23, 2017.
Heather Graven, Ralph Keeling, Joeri Rogelj, Changes to Carbon Isotopes in Atmospheric CO2 Over the Industrial Era and Into the Future, Global Biogeochemical Cycles, 23 October 2020.
Zhu Liu et al., Monitoring global carbon emissions in 2022, Nature Reviews Earth & Environment 4, 2023.













Leave a Reply
Vous devez vous connecter pour publier un commentaire.