Le carbone est un élément peu présent dans la croûte terrestre. Il y en aurait en moyenne 0,03 % en poids, soit 300 ppm (parties par million), derrière le chlore et le soufre. On le trouve essentiellement sous forme oxydée, dont les ions carbonate CO32–. Combiné avec des ions calcium Ca2+, ils forment la calcite CaCO3, qui est le principal minéral des calcaires. Cette roche est toujours d’origine sédimentaire : elle se forme sur les fonds marins ou plus rarement dans de l’eau douce. Le carbone est également présent sous forme gazeuse CO2 : c’est le dioxyde de carbone. Les organismes photosynthétiques ont la propriété de réduire le carbone pour l’assimiler, c’est-à-dire qu’elle lui donne des électrons. Tous les organismes vivants sont à base de carbone, auquel ils ajoutent de l’hydrogène, de l’oxygène, de l’azote et d’autres éléments en plus faibles quantités. On parle de carbone organique.
Le méthane CH4, un gaz comprenant du carbone fortement réduit, peut être produit de manière abiotique dans le manteau terrestre, mais les énormes stocks d’hydrates de méthane que recèlent le pergélisol et les océans sont d’origine biologique. C’est le principal constituant du gaz naturel, dont les réserves sont également importantes. Néanmoins, les flux de méthane entre l’atmosphère, les océans et les continents sont beaucoup plus faibles que les flux de CO2.
Le carbone atmosphérique
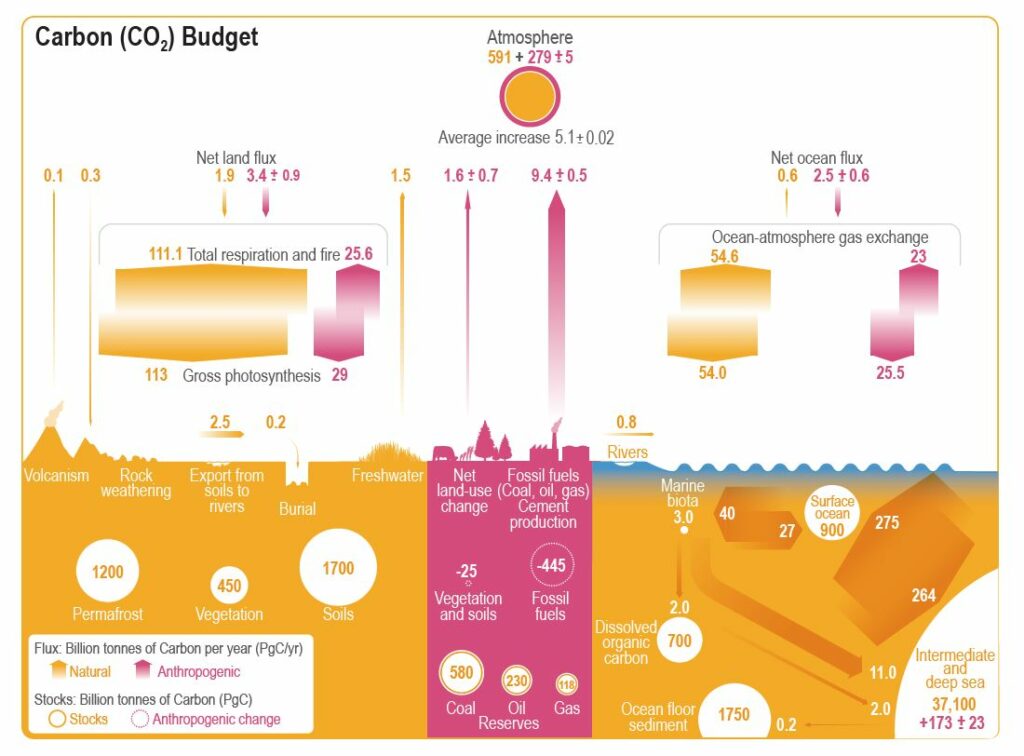
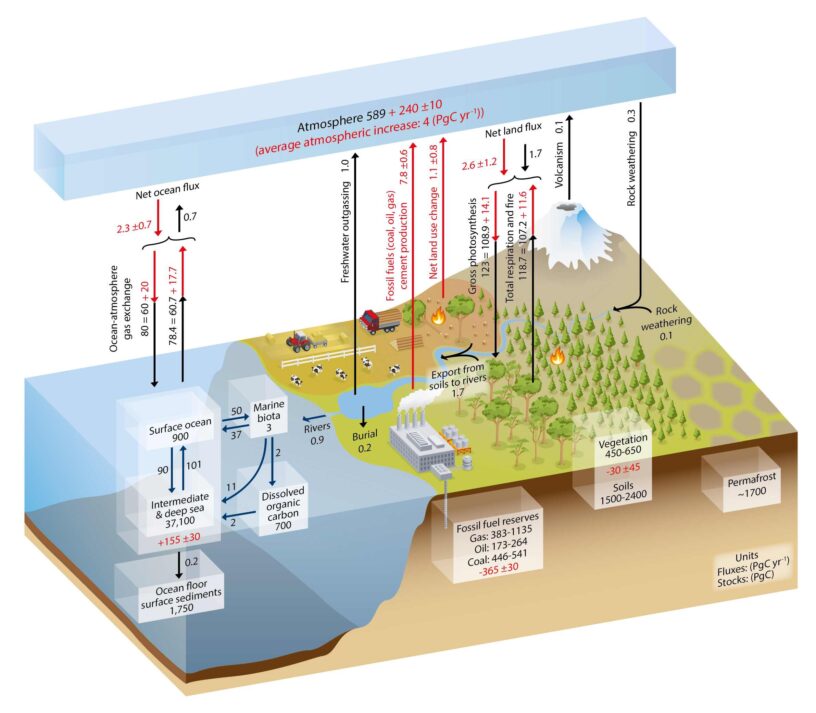
Il est facile de déterminer la quantité de carbone présent dans l’atmosphère : il suffit de mesurer la concentration du CO2, sachant que ce gaz est mélangé dans la troposphère par sa turbulence. Elle est généralement exprimée en ppmv (parties par million en volume). Actuellement, elle a dépassé les 410 ppmv, ce qui correspond à une masse de carbone de 870 ±5 Gt (gigatonnes, milliards de tonnes). Avant l’ère industrielle, cette masse était de 591 Gt, d’après les bulles d’air des carottes de glace de l’Antarctique. Pour obtenir la masse de CO2, il faut multiplier ce nombre par 3,66. Cela donne 2 163 Gt. Quant à la masse de méthane CH4, un gaz produit naturellement par la décomposition anaérobie de matière organique, elle était de 2 005 Mt (mégatonnes, millions de tonnes). Cela correspondait à 1,5 Gt de carbone. L’ajout de carbone au stock atmosphérique a été d’environ 2,35 Gt.
Le CO2 est stable dans l’atmosphère. Les seuls processus capables de le détruire sont la photosynthèse et sa dissolution dans l’eau, suivie de son assimilation par les plantes aquatiques ou de sa réaction avec les molécules d’eau, qui donne de l’acide carbonique H2CO3. Avant 1750, la photosynthèse consommait 113 Gt de carbone par an et les océans en absorbaient 54 Gt par an. Le temps de séjour du CO2 dans l’atmosphère était par conséquent de 591/(113 + 54) = 3,5 ans. Depuis 1750, l’humanité a déséquilibré ce bilan. Les émissions de CO2 dues à l’utilisation des combustibles fossiles et à la production de ciment sont actuellement de 9,4 ± 0,5 Gt/an. Elles se sont ajoutées aux 1,6 ± 0,5 Gt/an dues au changement d’utilisation des sols. La photosynthèse et les océans assimilent plus de CO2 sans parvenir à compenser ces émissions.
Le méthane, en revanche, n’est pas stable dans l’atmosphère. Il est en grande partie détruit par des radicaux hydroxyle OH, en donnant des radicaux méthyle CH3 et de la vapeur d’eau. Sa durée de vie moyenne dans l’atmosphère est de 9 ans.
Le carbone océanique
Les échanges de CO2 entre l’atmosphère et les océans sont guidés par la différence de pression partielle entre le CO2(g) atmosphérique et le CO2(aq) dissous, le gaz allant des fortes vers les faibles pressions. Dans l’eau de mer, l’acide carbonique H2CO3 se dissocie en protons H+ et ions bicarbonate HCO3 –. Ces derniers se dissocient à leur tour en protons H+ et en ions carbonate CO32 –. Cependant, des ions bicarbonate sont également produits à partir des ions carbonate, présents en abondance dans l’eau. La somme des équilibres s’écrit :
CO2(g) + H2O + CO32 – = 2HCO3 –.
Cette équation montre que l’ajout de CO2 dans l’eau entraîne la formation de bicarbonate, mais consomme aussi du carbonate. Cela fait baisser le pH de l’eau de mer. Actuellement, il est légèrement supérieur à 8, mais il a tendance à baisser du fait de l’activité humaine. Tout ce carbone est appelé du carbone inorganique dissous (CID). Il y en a 900 Gt dans les eaux de surface.
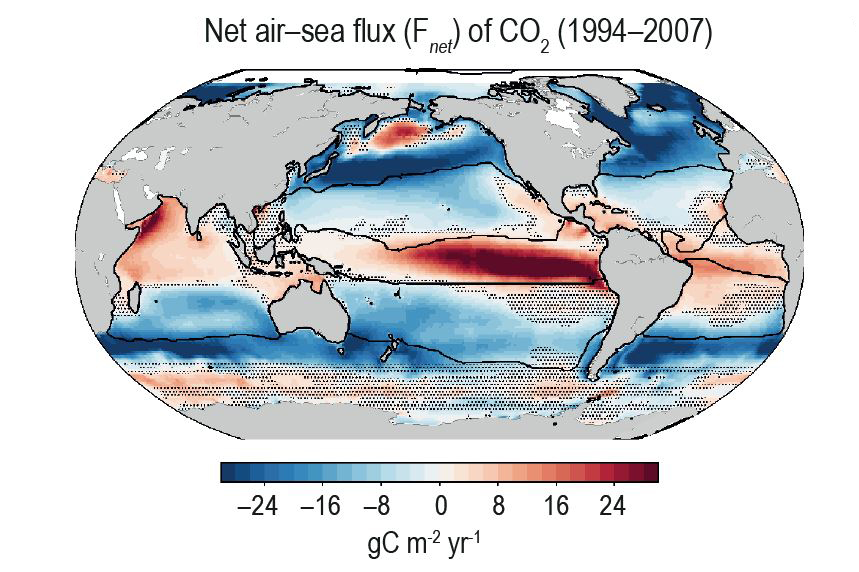
Ces échanges ne concernent que la couche superficielle des océans, séparée des eaux plus profondes par la thermocline. Celle-ci est située entre 100 et 350 mètres sous la surface et correspond à une baisse importante de température. L’océan superficiel comprend la zone photique, où la lumière permet la photosynthèse et où se concentre l’essentiel de la biomasse marine.
Il y a des échanges constants entre l’atmosphère et les océans. Ceux-ci ont tendance à gagner du CO2 aux hautes latitudes et à en perdre aux basses latitudes. Avant l’ère industrielle, les océans absorbaient 54 Gt/an de carbone et en relâchaient 54,6 Gt/an, si bien qu’ils en perdaient au total 0,6 Gt/an. Avec les émissions anthropiques de CO2 dans l’atmosphère, les deux flux ont augmenté, mais plus vers les océans que vers l’atmosphère. Ils gagnent maintenant 2,5 ± 0,6 Gt/an de carbone.
Les êtres vivants, quelle que soit leur taille, constituent le carbone organique particulaire (COP). La composition chimique du plancton non siliceux est symbolisée par la molécule de Redfield (CH2O)106(NH3)16(H3PO4)1Mex, où Me désigne des éléments trace métalliques. Sa synthèse consomme 106 molécules de CO2, 16 molécules de NO3 – et une molécule de HPO4 2–, ainsi que 122 molécules d’eau et de nombreux autres éléments, et produit 138 molécules de dioxygène. Le carbone est surabondant. En revanche, l’azote N et le phosphore P proviennent des continents ou de remontées d’eaux profondes et peuvent être limités, ce qui entrave la photosynthèse.

Le carbone inorganique particulaire (CIP) comprend deux minéraux de même formule chimique CaCO3, la calcite (principal constituant du calcaire) et l’aragonite. Des organismes les synthétisent en prélevant des ions bicarbonate de l’eau de mer. À partir de deux de ces molécules, ils fabriquent une molécule de carbonate de calcium et une molécule de CO2 :
Ca2+ + 2HCO3 – = CaCO3 + CO2(aq) + H2O,
si bien qu’ils augmentent la pression partielle du dioxyde de carbone dans l’eau et provoquent un rejet de ce gaz dans l’atmosphère. Les sédiments carbonatés sont en grande partie composés de débris de tels organismes (coquilles, morceaux de squelette…) déposés sur des plateformes continentales, à faible profondeur.
Les océans comportent aussi 700 Gt de carbone organique dissous (COD) composé de particules de taille inférieure à 0,5 micromètre, qui passent à travers les filtres. On y trouve des espèces chimiques complexes provenant de la décomposition de la matière organique.
La masse du phytoplancton est faible : elle ne comprend que 0,5 Gt de carbone. Les organismes hétérotrophes, qui se nourrissent par prédation, ainsi que des débris d’organismes de taille supérieure à 0,5 µm, en comportent 2,5 Gt, ce qui donne un total de 3 Gt pour le carbone organique particulaire. Autrement dit, la biomasse marine comporte seulement 3 Gt de carbone. Cela n’empêche pas la production primaire nette (NPP) d’être élevée. Elle est estimée à 40 Gt/an. Il s’agit de la fixation du carbone inorganique dissous des eaux de surface par les organismes vivants (production primaire brute), à laquelle la respiration autotrophe est retirée, puisqu’elle émet du CO2. Ce nombre est élevé parce que ces organismes ont une durée de vie faible, de quelques jours seulement pour le phytoplancton. Les organismes marins qui ne sont pas consommés par des prédateurs meurent et sont décomposés par des bactéries. Celles-ci restituent 27 Gt/an de carbone au stock de CID des eaux de surface. Un autre flux de 11 Gt/an prend la direction de l’océan intermédiaire et profond. De plus, un troisième flux de carbone de 2 Gt/an rejoint le stock de COD. Les trois flux représentent un total de 40 Gt/an : la biomasse marine rend à son environnement tout ce qu’elle consomme.
La matière organique qui tombe dans l’océan intermédiaire et profond est presque totalement dégradée par les bactéries. Leur carbone est donc converti en CID. Quant aux particules de calcite et d’aragonite, elles sont en partie dissoutes, et donc transformées elles aussi en carbone inorganique dissous. La lysocline est la profondeur à laquelle la dissolution commence, à cause de la baisse de la température de l’eau. À partir de la profondeur de compensation des carbonates, environ 5 000 mètres sous la surface, il ne reste quasiment plus de carbonates et la sédimentation est quartzo-argileuse. Du calcaire se dépose sur les dorsales océaniques parce qu’elles n’atteignent pas cette profondeur, mais il n’y en a pas sur les plaines abyssales. Il en résulte que la subduction des plaques océaniques entraîne très peu de carbone dans le manteau (cf. Volcanisme d’arc et cycle du carbone).
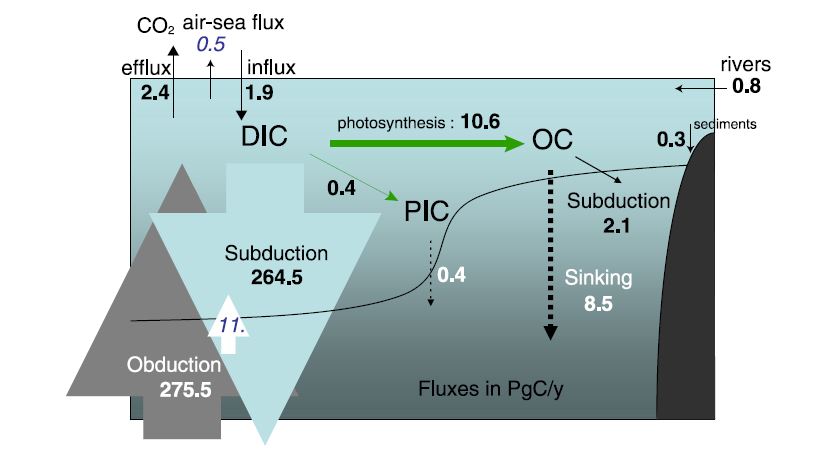
La pompe biologique est l’ensemble des processus biologiques qui transfèrent du carbone de la surface vers l’océan intermédiaire et profond. Elle est à l’origine de l’énorme stock de 37 100 Gt que celui-ci recèle, et qui s’ajoute aux 900 Gt de l’océan superficiel. Il y a également un flux direct de 264 Gt/an de carbone de la surface vers les profondeurs (appelé subduction), dû aux mouvements des masses d’eau, mais le flux inverse (obduction) lui est supérieur, puisqu’il vaut 275 Gt/an. Les remontées d’eau (upwellings en anglais) sont chargées en CID. Elles transportent également des nutriments qui profitent aux organismes marins. Ce flux ascendant de 11 Gt/an compense à peu près la pompe biologique.
Les océans perdent 0,2 Gt/an de carbone par sédimentation de COP résiduel et de calcaire sur les fonds marins. Ce stock est estimé à 1 750 Gt, soit presque la quantité de carbone contenue dans les sols. Les océans perdent également 0,6 Gt/an de carbone lors de leurs échanges avec l’atmosphère. Ces pertes sont compensées par l’apport des fleuves, évalué à 0,8 Gt/an.
Le carbone continental
Sur les terres émergées, le carbone est fixé par la végétation grâce à la photosynthèse. Elle prélève du CO2 dans l’air, qu’elle convertit en hydrates de carbone. Elle prélève ainsi 113 Gt/an de carbone dans l’atmosphère, mais elle rend à peu près une moitié par la respiration du feuillage et des racines. La différence est la production primaire nette. La masse de carbone de la végétation est estimée à 450 Gt. Celle du monde animal est négligeable. À leur mort, les végétaux restituent indirectement du carbone à l’atmosphère. Plus exactement, les bactéries qui dégradent leurs débris rejettent du CO2 par leur respiration. Les incendies de forêt en émettent également, si bien qu’au total, la végétation restitue à l’atmosphère 111,1 Gt/an de carbone. Cela donne un flux net de 1,9 Gt de carbone fixé chaque année par la végétation. Les émissions anthropiques de CO2 ont provoqué un accroissement de 3,4 ± 0,9 GtC/an.
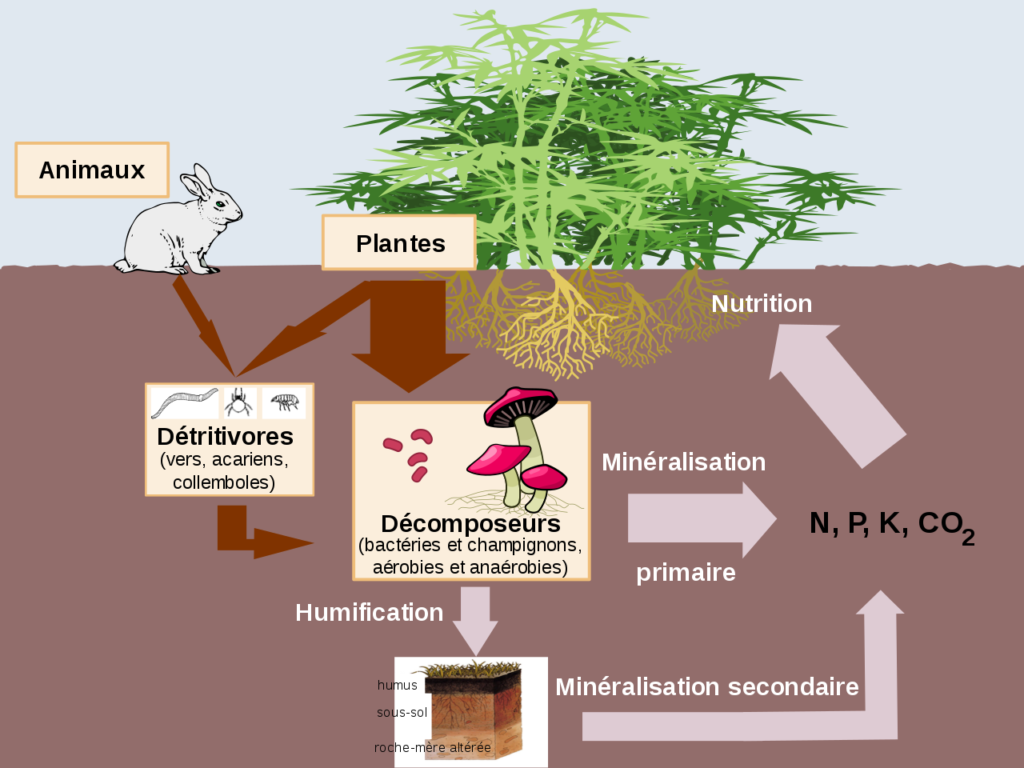
La matière végétale est dégradée dans les sols en humus, constitué de molécules organiques. Elle est associée à des minéraux issus de l’altération de la roche-mère (surtout des argiles), des oxydes et des hydroxydes de fer, constituant des complexes organo-métalliques. Parallèlement, la minéralisation primaire libère rapidement du CO2, des ions sulfate, phosphate, nitrate, etc., qui peuvent partir dans l’air et l’eau ou être incorporés dans l’humus. La minéralisation secondaire, qui peut durer des siècles, libère les mêmes nutriments, susceptibles d’être utilisés par la végétation. La photosynthèse ne permet pas de les produire. La quantité de carbone des sols est estimée à 1 700 Gt. Les cours d’eau emportent 2,5 Gt/an de carbone, mais un flux de 0,2 Gt/an est enfoui dans le sol et cette eau libère 1,5 Gt/an de carbone dans l’atmosphère, si bien que seul un flux de 0,8 Gt/an atteint les océans. Quant au pergélisol (permafrost en anglais), sol des régions froides en permanence gelé, il contient 1 200 Gt de carbone.
Le cycle géologique du carbone
Avant l’ère industrielle, l’atmosphère recevait des flux de carbone de 0,1 Gt/an par le volcanisme, de 1,5 Gt/an par le dégazage des eaux douces et de 0,6 Gt/an par les échanges avec les océans, ce qui faisait un total de 2,2 Gt/an. Ces gains compensaient les pertes de 1,9 Gt/an et de 0,3 Gt/an dues respectivement aux échanges avec la végétation et à l’altération des roches (on parle plus couramment d’érosion des roches, qui est donc un puits de carbone). Le stock de carbone de l’atmosphère était donc stable. En revanche, les terres perdaient 0,8 Gt/an de carbone au profit des océans, et rien ne compensait ce transfert.

Ces petits flux ont des effets importants à l’échelle des temps géologiques. L’altération des calcaires (et des dolomites), à l’origine des paysages karstiques, est une inversion de la synthèse de carbonate de calcium par les organismes marins :
CaCO3 + CO2(aq) + H2O → Ca2+ + 2HCO3 – .
Cette réaction se produit sous l’effet des pluies chargées en CO2, qui ruissellent sur les roches. Elles provoquent une dissolution du calcaire. Le carbone prélevé à l’atmosphère est transféré vers les mers sous forme d’ions bicarbonate, mais cette pompe à CO2 n’a qu’une action provisoire, car l’activité biologique des océans est capable de restituer intégralement le CO2 à l’atmosphère, par la synthèse de CaCO3. Il s’agit par conséquent d’un cycle fermé qui est sans effet sur le stock de carbone atmosphérique.
Le seul processus capable de diminuer « pour de bon » ce stock est l’altération des silicates. Les réactions diffèrent selon les minéraux. Pour la wollastonite CaSiO3, qui est le plus simple des silicates calciques, elle s’écrit:
CaSiO3 + 2 CO2 + 3H2O → Ca2+ + 2 HCO3– + H4SiO4.
L’anorthite Al2Si2O8Ca est un silicate calcique plus fréquent, de la famille des feldspaths. Il réagit avec l’eau chargée en CO2 pour donner des ions calcium et bicarbonate, ainsi que de la kaolinite, qui est une argile :
2 Al2Si2O8Ca + 4 CO2 + 6 H2O → 2 Ca2+ + 4 HCO3– + Si4O10Al4(OH).
Après l’altération de l’anorthite, les deux ions Ca2+ peuvent s’associer avec les quatre ions HCO₃⁻ (généralement avec l’aide d’organismes vivants) pour donner deux molécules de CaCO3 et deux molécules de CO2, ainsi que de l’eau. Au total, quatre molécules de CO2 sont utilisées mais seules deux sont rendues.
L’enstatite MgSiO3, qui est un pyroxène et un silicate magnésien, réagit également avec de l’eau chargée de CO2, pour donner des ions magnésium et bicarbonate, ainsi que de la silice :
MgSiO3 + 2 CO2 + H2O → Mg2+ + 2 HCO3– + SiO2.
Si des ions calcium sont présents dans la solution, du calcaire est susceptible de précipiter, mais une seule molécule de CO2 sera rendue pour deux molécules prélevées dans l’atmosphère.
Les volcans rejettent du CO2 provenant de la croûte et du surtout manteau, avec un flux de 0,07 Gt de carbone par an, chiffre arrondi par l’AR6 en 0,1 Gt/an. On parle ici des volcans aériens. Une grande partie du volcanisme se déroule dans les profondeurs océaniques, sur les dorsales. D’après une étude récente, flux de CO2 émis par la totalité des dorsales est d’environ 0,058 Gt/an. La circulation hydrothermale, c’est-à-dire l’infiltration de l’eau dans le plancher suivi de son chauffage et de sa remontée, consomme du CO2 par précipitation de carbonates dans les basaltes.
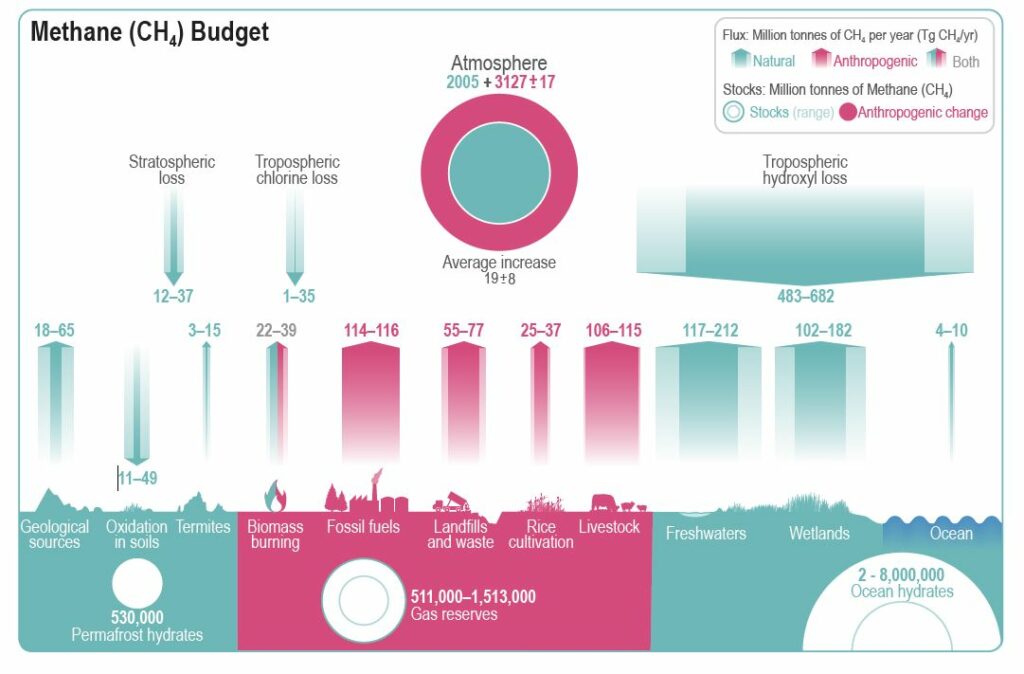
La matière organique qui sédimente sur les terres et dans les mers en échappant à l’oxydation devient du kérogène. Cette substance peut produire du charbon, du pétrole ou du gaz naturel, lequel comprend du méthane et d’autres hydrocarbures plus lourds. D’après une estimation de la U.S. Energy Information Administration de 2014, ces combustibles fossiles sont du charbon à 66 %, du pétrole à 21 % et du gaz à 13 %. Ils renfermeraient entre 3 700 et 4 200 Gt de carbone. Cependant, l’ensemble des formes dispersées et non exploitables de carbone réduit, dont le kérogène, pourraient représenter jusqu’à un quart du carbone de la croûte terrestre. Les hydrates (ou clathrates) de méthane des sédiments océaniques et du pergélisol sont encore mal connus, mais environ 10 000 Gt de carbone leur sont attribuées.













Leave a Reply
Vous devez vous connecter pour publier un commentaire.