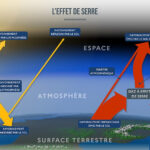
Un aspect peu connu des éruptions volcaniques est l’émission de gaz. Ils jouent pourtant un rôle important et sont toujours à l’origine des éruptions explosives. L’émission de gaz par un volcan endormi peut être l’indice d’un prochain réveil, de même qu’un changement de composition. Il s’agit toujours au moins à 60 % de vapeur d’eau. Les deux autres gaz les plus abondants sont le dioxyde de carbone et le dioxyde de soufre SO2, un gaz incolore et acre qui devient liquide à moins de 10 °C. Parmi les gaz moins abondants figurent le soufre et l’acide chlorhydrique HCl. Le soufre est à l’état gazeux au-dessus de 444,61 °C et à l’état liquide au-dessus de 115,21 °C. Il sort donc des volcans à l’état gazeux, puis se liquéfie et se solidifie. Il brûle en émettant une flamme bleue, avec production de SO₂. L’acide chlorhydrique est un gaz incolore que l’on utilise sous forme dissoute. Les volcans émettent également de l’acide fluorhydrique HF. Cela explique le caractère toxique des cendres volcaniques. Elles sont irritantes pour le nez et la gorge.
Un effet spectaculaire de ce dégazage est la constitution de lacs acides dans les volcans. Certains cratères inactifs se remplissent d’eau de pluie et celle-ci s’acidifie par dissolution des gaz. Le dioxyde de soufre réagit avec l’eau selon la réaction 3SO2 + 3H2O = 2H2SO4 + H2O + S. Il y a ainsi une production d’acide sulfurique H2SO4 et de soufre. Le lac le plus acide est celui du Kawah Ijen en Indonésie. C’est un cône volcanique de 2 368 mètres d’altitude situé à l’extrémité orientale de l’île de Java. Il s’est formé sur une caldeira d’une vingtaine de kilomètres de diamètre, résultant d’une explosion cataclysmique qui s’est produite il y a environ 50 000 ans. Le lac a une couleur bleu turquoise à vert émeraude qui lui a donné son nom : « cratère vert » en javanais. Il est à 2 148 mètres d’altitude et sa profondeur atteint 182 mètres. La température de ses eaux oscille entre 20 °C et 40 °C et leur pH est inférieur à 0,3. Du soufre condensé à la sorte de fumerolles est exploité par des mineurs dans des conditions extrêmement pénibles. Une partie provient du sulfure d’hydrogène H₂S grâce à la réaction 2 H2S + O2 → 2 S + 2 H2O. De nuit, il est possible d’observer les flammes bleues dues à la combustion du soufre.

















Leave a Reply
Vous devez vous connecter pour publier un commentaire.